发布日期:2022-08-05
新羿生物热烈恭贺河南真实生物科技有限公司(以下简称“真实生物”)的口服抗新冠药物阿兹夫定(Azvudine,简称FNC)附条件获批上市!

国产首个口服抗新冠药——阿兹夫定
据报道,支持阿兹夫定上市申请的关键Ⅲ期注册临床试验,是采用多中心、随机、双盲、安慰剂对照的临床试验设计。临床试验结果显示阿兹夫定片可以显著缩短中度的新型冠状病毒感染肺炎患者症状改善时间,提高临床症状改善的患者比例,达到临床优效结果。首次给药后第7天临床症状改善的受试者比例阿兹夫定组40.43%,安慰剂组10.87%(P值<0.001),受试者临床症状改善的中位时间阿兹夫定组与安慰剂组有极显著统计学差异(P值<0.001)。
新羿生物作为拥有全流程自主知识产权的数字PCR生产厂家,在疫情爆发后,与清华大学等合作单位紧密合作,成功研发了新型冠状病毒(2019-nCoV)核酸检测试剂盒(荧光PCR法),并第一时间联系合作机构进行评价,参与制备新冠病毒核酸标准品、助力多项新冠诊疗机理研究。该试剂盒在2022年1月10日正式获得国家药品监督管理局(NMPA)医疗器械批文(国械注准:20223400015)。这是NMPA首个基于数字PCR技术的新冠检测试剂批文,也是全球首个经评审后正式获批的将数字PCR技术运用于感染性疾病领域的检测产品。这意味着这项新技术的自主可控和进一步成熟。
北京新羿生物科技有限公司(以下简称“新羿生物),其自主研发的 “新型冠状病毒(2019-nCoV)核酸检测试剂盒(荧光PCR法)”在2022年1月正式获得国家药品监督管理局(NMPA)医疗器械批文(国械注准:20223400015)。这是NMPA首个基于数字PCR技术的新冠检测试剂批文,也是全球首个经评审后正式获批的将数字PCR技术运用于感染性疾病领域的检测产品。这意味着这项新技术的自主可控和进一步成熟。该产品由新羿生物与清华大学和多家医院及CDC等单位联合研发,由新羿生物全资子公司新羿制造科技(北京)有限公司生产。
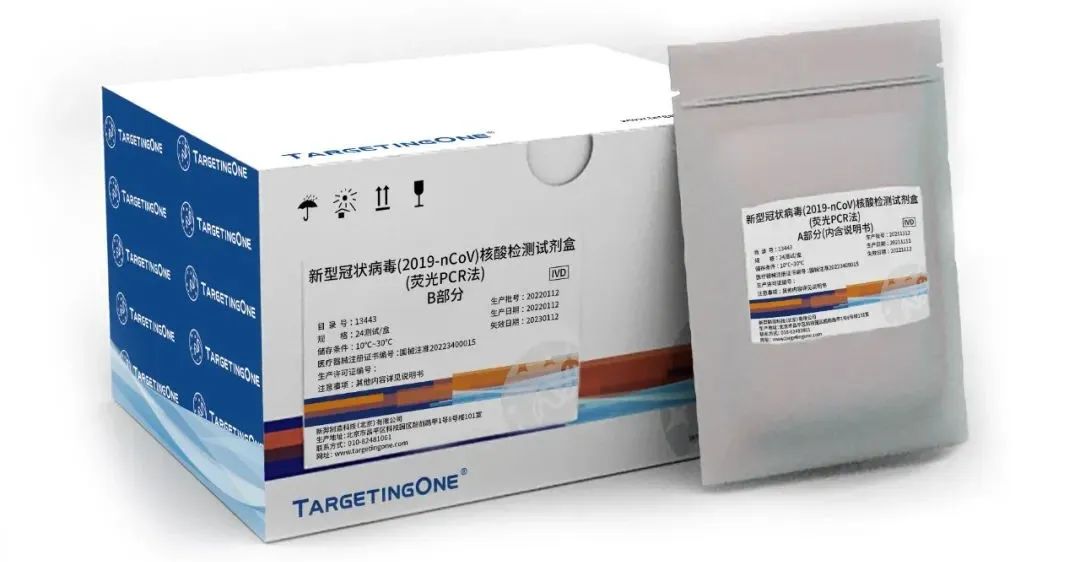
国产首个NMPA获批的基于数字PCR的新冠检测试剂盒
数字PCR技术,被称为“第三代PCR技术”,提高了核酸检测的灵敏度和准确性。与荧光定量PCR不同,数字PCR无需标准品,利用微流体等技术将PCR反应体系分割成数万微液滴,通过单分子扩增直接获得靶标核酸分子数。该产品对于低载量病毒核酸检测具有显著优势,灵敏度可达100拷贝/mL,有效提高了检测灵敏度,大大降低阳性漏检情况。该产品对全球范围内目前常见的变异株:Delta株、Omicron株等,不会出现漏检和脱靶,为全球新冠疫情防控与核酸检测提供了更精准的利器。
应用场景
●对于疾控密切接触人群进行检测;
●对于海关隔离医学观察人群进行检测;
●对于疑似病例进行检测;
●用于抗新冠药物进行药理研究和临床评价;
●对于新冠患者的临床治疗进行研究指导。
●灵敏度高:最低检测下限为100拷贝/mL;
●操作简单:一步上样,人为误差小;
●封闭检测:防止气溶胶污染和样本损失,预防假阳性;
●特异性好:与其他常见呼吸道病原体(病毒、细菌、真菌)无交叉反应。
真实生物是一家以研发为驱动力的生物科技公司,致力于治疗病毒性、肿瘤及心脑血管疾病的创新药物的研发、制造及商业化。真实生物的使命是通过真正的创新来改善人类健康。通过对创新的不懈追求,真实生物旨在寻找更新及更好的治疗方案,以满足未满足的临床需求,并逐步确立真实生物在抗病毒及抗肿瘤药物研发方面的优势,成为具有全球竞争力的生物制药公司。

京公网安备 11010802028168号