发布日期:2022-04-24

欧盟市场是各IVD企业竞争的主要市场之一,而CE认证作为产品进入欧盟市场的“签证”,是欧盟市场对于相关产品准入的强制性要求。
2022年5月26日IVDR将正式实施,自实施之日起,IVDR将取代原欧盟体外诊断设备指令(IVDD)。新发布的IVDR,在法规层级上从原先的Directive(指令)上升为Regulation(法规),标志着欧盟当局对医疗设备领域的进一步重视。IVDR新法规较之前的相关应用有很大改动,在技术文档审查、临床评估、上市后监管等各方面都提出了更严格的要求。对于 IVD企业来说,提高了欧盟市场的准入门槛,并且对其监管更加严格,给企业带来极大的挑战和机遇。与此同时,新羿生物陆续开展在新的IVDR法规下CE证书的办理,以更好应对IVDR时代的到来。

核酸提取试剂瓶装版
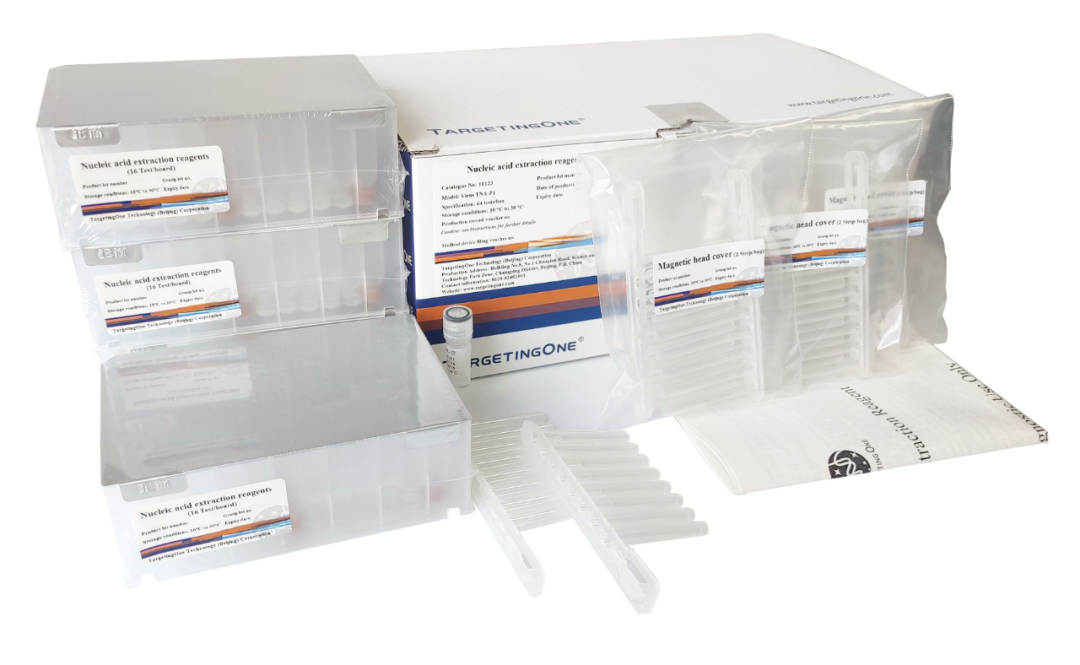
核酸提取试剂预封装版

京公网安备 11010802028168号